Soal UAS/PAS Kimia Kelas 10 11 12 Semester 1 Kurikulum 2013 Tahun 2019
Soal UAS/PAS Kimia Kelas 10 11 12 Semester 1 Kurikulum 2013 Tahun 2019 ini merupakan update terbaru yang akan kami bagikan pada kesempatan kali ini. Pada update kali ini kami bagikan sebagai bahan persiapan khususnya untuk kebutuhan latihan para peserta didik agar memiliki persiapan yang matang dalam mengerjakan Soal-soal UAS nanti khususnya pada mapel Kimia.
Dalam Soal Kimia ini kami sediakan juga lengkap dengan Kunci Jawabannya (Pembahasannya) untuk memudahkan guru dalam melakukan pemeriksaan hasil latihan siswa. Berikut tampilan soal dan juga link yang bisa anda gunakan untuk mendownloadnya.
Menjelang berakhirnya pembelajaran Semester 1 (Ganjil) Tahun Pelajaran 2019/2020, tentunya semakin dekat pula dengan penyelenggaraan Penilaian Akhir Semester (UAS). Tentunya kesiapan para peserta didik menjadi tanggungjawab bapak/ibu semuanya sebagai pendidik.
Dalam Soal Kimia ini kami sediakan juga lengkap dengan Kunci Jawabannya (Pembahasannya) untuk memudahkan guru dalam melakukan pemeriksaan hasil latihan siswa. Berikut tampilan soal dan juga link yang bisa anda gunakan untuk mendownloadnya.
Menjelang berakhirnya pembelajaran Semester 1 (Ganjil) Tahun Pelajaran 2019/2020, tentunya semakin dekat pula dengan penyelenggaraan Penilaian Akhir Semester (UAS). Tentunya kesiapan para peserta didik menjadi tanggungjawab bapak/ibu semuanya sebagai pendidik.
Soal UAS/PAS Kimia Kelas 10 Semester 1 Kurikulum 2013 Tahun 2019
1. Para ilmuwan dalam bekerja selalu berdasarkan....
a. Data – Percobaan – Hipotesa –Masalah – Kesimpulan – Percobaan selanjutnya – Laporan
b. Masalah – Hipotesa – Percobaan – Data – Percobaan selanjutnya – kesimpulan – Laporan
c. Masalah – Data – Hipotesa –Percobaan – Kesimpulan – Percobaan selanjutnya – Laporan
d. Hipotesa – Percobaan – Data – Masalah – Percobaan selanjutnya – kesimpulan – Laporan
e. Hipotesa - Masalah – Data – Percobaan – Kesimpulan – Percobaan selanjutnya – Laporan
Jawaban : C
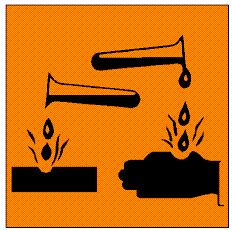
2. Perhatikan simbol berikut :
Simbol tersebut berarti....
a. Beracun
b. Korosif
c. Mudah meledak
d. Mudah megiritasi
e. Berbahaya bagi lingkungan
Jawaban : B
3. Untuk mereaksikan larutan dalam jumlah sedikit menggunakan....
a. Erlen meyer
b. Gelas kimia
c. Gelas ukur
d. Labu ukur
e. Tabung reaksi
Jawaban : E
4. Rutherford merupakan orang yang pertama kali mengemukakan adanya....
a. Inti atom
b. Kulit atom
c. Elektron
d. Proton
e. Orbital
Jawaban : A
a. Data – Percobaan – Hipotesa –Masalah – Kesimpulan – Percobaan selanjutnya – Laporan
b. Masalah – Hipotesa – Percobaan – Data – Percobaan selanjutnya – kesimpulan – Laporan
c. Masalah – Data – Hipotesa –Percobaan – Kesimpulan – Percobaan selanjutnya – Laporan
d. Hipotesa – Percobaan – Data – Masalah – Percobaan selanjutnya – kesimpulan – Laporan
e. Hipotesa - Masalah – Data – Percobaan – Kesimpulan – Percobaan selanjutnya – Laporan
Jawaban : C
2. Perhatikan simbol berikut :
Simbol tersebut berarti....
a. Beracun
b. Korosif
c. Mudah meledak
d. Mudah megiritasi
e. Berbahaya bagi lingkungan
Jawaban : B
3. Untuk mereaksikan larutan dalam jumlah sedikit menggunakan....
a. Erlen meyer
b. Gelas kimia
c. Gelas ukur
d. Labu ukur
e. Tabung reaksi
Jawaban : E
4. Rutherford merupakan orang yang pertama kali mengemukakan adanya....
a. Inti atom
b. Kulit atom
c. Elektron
d. Proton
e. Orbital
Jawaban : A
5. Gagasan utama dalam teori atom Niels Bohr adalah....
a. Gagasan tentang partikel dasar
b. Gagasan tentang inti atom
c. Gagasan tentang tingkat energi dalam atom
d. Gagasan tentang isotop
e. Gagasan tentang orbital
Jawaban : C
6. Partikel penyusun inti atom adalah....
a. Proton
b. Neutron
c. Neutron dan elektron
d. Proton dan neutron
e. Proton, elektron, dan neutron
Jawaban : D
7. Partikel bermutan positif yang terdapat dalam inti atom adalah....
a. Proton
b. Inti
c. Elektron
d. Neutron
e. Atom
Jawaban : A
8. Berikut ini beberapa gambar model atom.
Model atom Rutherford adalah nomor....
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : C
9. Suatu atom unsur mempunyai nomor massa 23 dan di dalam inti nya terdapat 12 neutron, banyaknya elektron yang terdapat pada kulit terluar atom ini adalah....
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : A
a. Gagasan tentang partikel dasar
b. Gagasan tentang inti atom
c. Gagasan tentang tingkat energi dalam atom
d. Gagasan tentang isotop
e. Gagasan tentang orbital
Jawaban : C
6. Partikel penyusun inti atom adalah....
a. Proton
b. Neutron
c. Neutron dan elektron
d. Proton dan neutron
e. Proton, elektron, dan neutron
Jawaban : D
7. Partikel bermutan positif yang terdapat dalam inti atom adalah....
a. Proton
b. Inti
c. Elektron
d. Neutron
e. Atom
Jawaban : A
8. Berikut ini beberapa gambar model atom.
Model atom Rutherford adalah nomor....
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : C
9. Suatu atom unsur mempunyai nomor massa 23 dan di dalam inti nya terdapat 12 neutron, banyaknya elektron yang terdapat pada kulit terluar atom ini adalah....
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : A
10. Atom unsur yang mempunyai 8 elektron valensi adalah atom unsur dengan nomor atom....
a. 8
b. 10
c. 12
d. 16
e. 20
Jawaban : B
a. 8
b. 10
c. 12
d. 16
e. 20
Jawaban : B
11. Nomor atom suatu unsur adalah 58 dan bilangan massa salah satu isotopnya adalah 140. Jumlah elektron, proton, dan neutron yang terdapat dalam atom unsur tersebut adalah....
a. Elektron 58, proton 24, neutron 58
b. Elektron 58, proton 82, neutron 58
c. Elektron 58, proton 58, neutron 24
d. Elektron 58, proton 58, neutron 140
e. Elektron 58, proton 58, neutron 82
Jawaban : C
a. Elektron 58, proton 24, neutron 58
b. Elektron 58, proton 82, neutron 58
c. Elektron 58, proton 58, neutron 24
d. Elektron 58, proton 58, neutron 140
e. Elektron 58, proton 58, neutron 82
Jawaban : C
12. Bilangan kuantum magnetik menunjukkan ....
a. Arah ruang orbital
b. Tingkat energi kulit
c. Subtingkat energi elektron
d. Perbedaan arah rotasi elektron
e. Keboleh jadian menemukan elektron
Jawaban : A
13. Konfigurasi elektron yang benar untuk atom K dengan nomor atom 19 adalah....
a. 1s2, 2s2, 2p6, 3s2, 3p6, 3d1
b. 1s2, 2s2, 2p6, 3s2, 3p6, 4s1
c. 1s2, 2s2, 3s2, 3p6, 4s2, 4p4
d. 1s2, 2s2, 3s2, 3p6, 4s1, 4p5
e. 1s2, 2s2, 2p6, 3s2, 3p6, 4s2
Jawaban : B
14. Suatu atom X bermuatan -2. Jika nomor atom dan nomor massa atom tersebut 8 dan 16, jumlah elektronnya adalah....
a. 8
b. 9
c. 10
d. 18
e. 20
Jawaban : C
15. Jumlah elektron maksimum pada kulit N adalah....
a. 2
b. 8
c. 18
d. 32
e. 50
Jawaban : D
16. Keempat bilangan kuantum untuk elektron terakhir dari atom S dengan nomor atom 16 adalah....
a. n = 3, l = 1, m = -1, s = - 1/2
b. n = 3, l = 1, m = 0, s = -1/2
c. n = 3, l = 1, m = 0, s = +1/2
d. n = 3, l = 2, m = 0, s = + ½
e. n = 2, l = 1, m = -1, s = - ½
Jawaban : A
17. Atom-atom yang memiliki nomor atom sama dan nomor massa berbeda adalah....
a. Isotop
b. Isobar
c. Isoton
d. Isoelektron
e. Isomer
Jawaban : A
18. Pengelompokan unsur- unsur yang dilakukan oleh Lavoisier berdasarkan ....
a. Nomor atom
b. Nomor massa
c. Sifat periodik
d. Jari-jari atom
e. Sifat logam dan non logam
Jawaban : E
19. Susunan berkala unsur-unsur Mendeleev disusun berdasarkan ....
a. Kenaikan massa atau sifat kimia unsur
b. Susunan elektron unsur-unsur
c. Kenaikan nomor atom
d. Kenaikan nomor massa dan sifat unsur
e. Sifat logam dan non logam
Jawaban : D
20. Unsur-unsur yang memiliki persamaan sifat diletakkan dalam ....
a. Golongan yang sama
b. Periode yang sama
c. Wujud yang sama
d. Blok yang sama
e. Kulit yang sama
Jawaban : A
21. Unsur-unsur yang terletak dalam satu periode memiliki....
a. Jumlah kulit yang sama
b. Jumlah proton yang sama
c. Jumlah proton yang sama
d. Jumlah neutron yang sama
e. Jumlah elektron valensi yang sama
Jawaban : A
22. Unsur-unsur yang terletak pada periode ke – 3 adalah....
a. Li
b. F
c. Ar
d. K
e. Ca
Jawaban : C
23. Unsur dengan konfigurasi elektron 2,8,18,8,1 dalam sistem periodik terletak pada....
a. Periode 4, golongan IA
b. Periode 4, golongan IIA
c. Periode 4, golongan IB
d. Periode 5, golongan IA
e. Periode 5, golongan IVA
Jawaban : D
a. Arah ruang orbital
b. Tingkat energi kulit
c. Subtingkat energi elektron
d. Perbedaan arah rotasi elektron
e. Keboleh jadian menemukan elektron
Jawaban : A
13. Konfigurasi elektron yang benar untuk atom K dengan nomor atom 19 adalah....
a. 1s2, 2s2, 2p6, 3s2, 3p6, 3d1
b. 1s2, 2s2, 2p6, 3s2, 3p6, 4s1
c. 1s2, 2s2, 3s2, 3p6, 4s2, 4p4
d. 1s2, 2s2, 3s2, 3p6, 4s1, 4p5
e. 1s2, 2s2, 2p6, 3s2, 3p6, 4s2
Jawaban : B
14. Suatu atom X bermuatan -2. Jika nomor atom dan nomor massa atom tersebut 8 dan 16, jumlah elektronnya adalah....
a. 8
b. 9
c. 10
d. 18
e. 20
Jawaban : C
15. Jumlah elektron maksimum pada kulit N adalah....
a. 2
b. 8
c. 18
d. 32
e. 50
Jawaban : D
16. Keempat bilangan kuantum untuk elektron terakhir dari atom S dengan nomor atom 16 adalah....
a. n = 3, l = 1, m = -1, s = - 1/2
b. n = 3, l = 1, m = 0, s = -1/2
c. n = 3, l = 1, m = 0, s = +1/2
d. n = 3, l = 2, m = 0, s = + ½
e. n = 2, l = 1, m = -1, s = - ½
Jawaban : A
17. Atom-atom yang memiliki nomor atom sama dan nomor massa berbeda adalah....
a. Isotop
b. Isobar
c. Isoton
d. Isoelektron
e. Isomer
Jawaban : A
18. Pengelompokan unsur- unsur yang dilakukan oleh Lavoisier berdasarkan ....
a. Nomor atom
b. Nomor massa
c. Sifat periodik
d. Jari-jari atom
e. Sifat logam dan non logam
Jawaban : E
19. Susunan berkala unsur-unsur Mendeleev disusun berdasarkan ....
a. Kenaikan massa atau sifat kimia unsur
b. Susunan elektron unsur-unsur
c. Kenaikan nomor atom
d. Kenaikan nomor massa dan sifat unsur
e. Sifat logam dan non logam
Jawaban : D
20. Unsur-unsur yang memiliki persamaan sifat diletakkan dalam ....
a. Golongan yang sama
b. Periode yang sama
c. Wujud yang sama
d. Blok yang sama
e. Kulit yang sama
Jawaban : A
21. Unsur-unsur yang terletak dalam satu periode memiliki....
a. Jumlah kulit yang sama
b. Jumlah proton yang sama
c. Jumlah proton yang sama
d. Jumlah neutron yang sama
e. Jumlah elektron valensi yang sama
Jawaban : A
22. Unsur-unsur yang terletak pada periode ke – 3 adalah....
a. Li
b. F
c. Ar
d. K
e. Ca
Jawaban : C
23. Unsur dengan konfigurasi elektron 2,8,18,8,1 dalam sistem periodik terletak pada....
a. Periode 4, golongan IA
b. Periode 4, golongan IIA
c. Periode 4, golongan IB
d. Periode 5, golongan IA
e. Periode 5, golongan IVA
Jawaban : D
24. Perhatikan konfigurasi elektron berikut ini :
A = 2
B = 2,8,1
C = 2,8,2
D = 2,8,18,8
Unsur-unsur yang terletak dalam satu golongan adalah....
a. A dan B
b. A dan C
c. A dan D
d. B dan C
e. C dan D
Jawaban : C
25. Unsur oksigen dalam sistem periodik unsur terletak pada golongan ....
a. IIIA
b. IVA
c. VA
d. VIA
e. VIIA
Jawaban : D
26. Sekelompok unsur berikut yang merupakan unsur alkali adalah....
a. Na,Cl,Al
b. Li, Na, K
c. Mg,Ca, Sr
d. C,N,O
e. F,Cl,Br
Jawaban : B
27. Unsur-unsur transisi dalam sistem periodik unsur terletak antara golongan ....
a. IA dan IIA
b. IIA dan IIIA
c. IIA dan IIIB
d. IIB dan IIIA
e. IIB dan IIIB
Jawaban : B
28. Dengan bertambahnya nomor atom dalam satu periode dari kiri ke kanan, sifat unsur yang memiliki kecenderungan semakin kecil adalah....
a. Jari-jari atom
b. Afinitas elektron
c. Keelektronegatifan
d. Energi ionisasi
e. Kereaktifan
Jawaban : A
29. Elektron ditemukan oleh....
a. J.J Thomson
b. CHOICE BLANK
c. E. Rutherford
d. Henry Becquerel
e. R.A. Milikan
f. Chadwick
Jawaban : A
30. Elektron yang mengelilingi inti tidak akan jatuh ke inti, sebab....
A. Elektron mempunyai massa yang relatif kecil
B. Elektron selalu dalam keadaan diam
C. Antara inti dan elektron terdapat penghalang
D. Energi tolak menolak antara inti dan elektron relatif besar
E. Elektron bergerak menurut lintasan – lintasan dan jarak tertentu dari inti
Jawaban :E
31. Deret senyawa berikut ini tergolong senyawa kovalen, kecuali....
A. HF, HCl, HI
B. BH3, BF3, CO2
C. H2O, NH3, CO2
D. Li2O, CaO, MgO
E. IF3, CCl4, CLF3
Jawaban : D
c. VA
d. VIA
e. VIIA
Jawaban : D
26. Sekelompok unsur berikut yang merupakan unsur alkali adalah....
a. Na,Cl,Al
b. Li, Na, K
c. Mg,Ca, Sr
d. C,N,O
e. F,Cl,Br
Jawaban : B
27. Unsur-unsur transisi dalam sistem periodik unsur terletak antara golongan ....
a. IA dan IIA
b. IIA dan IIIA
c. IIA dan IIIB
d. IIB dan IIIA
e. IIB dan IIIB
Jawaban : B
28. Dengan bertambahnya nomor atom dalam satu periode dari kiri ke kanan, sifat unsur yang memiliki kecenderungan semakin kecil adalah....
a. Jari-jari atom
b. Afinitas elektron
c. Keelektronegatifan
d. Energi ionisasi
e. Kereaktifan
Jawaban : A
29. Elektron ditemukan oleh....
a. J.J Thomson
b. CHOICE BLANK
c. E. Rutherford
d. Henry Becquerel
e. R.A. Milikan
f. Chadwick
Jawaban : A
30. Elektron yang mengelilingi inti tidak akan jatuh ke inti, sebab....
A. Elektron mempunyai massa yang relatif kecil
B. Elektron selalu dalam keadaan diam
C. Antara inti dan elektron terdapat penghalang
D. Energi tolak menolak antara inti dan elektron relatif besar
E. Elektron bergerak menurut lintasan – lintasan dan jarak tertentu dari inti
Jawaban :E
31. Deret senyawa berikut ini tergolong senyawa kovalen, kecuali....
A. HF, HCl, HI
B. BH3, BF3, CO2
C. H2O, NH3, CO2
D. Li2O, CaO, MgO
E. IF3, CCl4, CLF3
Jawaban : D
32. Nomor atom unsur P,Q, R,S adalah6,9,11,18. Pasangan unsur-unsur yang diharapkan dapat membentuk ikatan ion adalah....
A. P dan Q
B. R dan Q
C. Q dan S
D. S danR
E. P dan S
Jawaban : B
33. Pasangan senyawa berikut yang keduanya berikatan ion adalah....
A. HF dan HCl
B. NaBr dan K2O
C. FeCl2 dan H2O
D. C2H4 dan CaC2
E. CO2 dan N2O4
Jawaban : B
34. Unsur Ca memiliki nomor atom 20, akan membentuk konfigurasi elektron seperti gas mulia dengan cara....
A. Menerima 1 elektron
B. Menerima 2 elektron
C. Melepas 1 elektron
D. Melepas 2 elektron
E. Melepas 6 elektron
Jawaban : D
35. Zat yang bersifat polar adalah....
A. CH4
B. BF3
C. NH3
D. CO2
E. PCl5
Jawaban : C
A. P dan Q
B. R dan Q
C. Q dan S
D. S danR
E. P dan S
Jawaban : B
33. Pasangan senyawa berikut yang keduanya berikatan ion adalah....
A. HF dan HCl
B. NaBr dan K2O
C. FeCl2 dan H2O
D. C2H4 dan CaC2
E. CO2 dan N2O4
Jawaban : B
34. Unsur Ca memiliki nomor atom 20, akan membentuk konfigurasi elektron seperti gas mulia dengan cara....
A. Menerima 1 elektron
B. Menerima 2 elektron
C. Melepas 1 elektron
D. Melepas 2 elektron
E. Melepas 6 elektron
Jawaban : D
35. Zat yang bersifat polar adalah....
A. CH4
B. BF3
C. NH3
D. CO2
E. PCl5
Jawaban : C
36. Diketahui harga keelektronegatifan beberapa unsur sebagai berikut :
H = 2,1 ; Cl = 2,0 ; F = 4,0 ; Br = 2,8
Senyawa berikut iniyang paling polar adalah....
A. HF
B. HCl
C. BrCl
D. FCl
E. FBr
Jawaban : D
H = 2,1 ; Cl = 2,0 ; F = 4,0 ; Br = 2,8
Senyawa berikut iniyang paling polar adalah....
A. HF
B. HCl
C. BrCl
D. FCl
E. FBr
Jawaban : D
37. Pasangan senyawa berikut ini yang keduanya berikatan kovalen adalah....
A. NaCl dan HCl
B. HBr dan KCl
C. HCl dan H2O
D. MgCl2 dan NaCl
E. H2O dan CaCl
Jawaban : C
A. NaCl dan HCl
B. HBr dan KCl
C. HCl dan H2O
D. MgCl2 dan NaCl
E. H2O dan CaCl
Jawaban : C
38. Unsur X dengan nomor atom 12 bersenyawa dengan unsur Y dengan nomor atom 17. Rumus kimia yang terbentuk antara unsur X dan Y adalah....
A. XY
B. XY2
C. XY3
D. X2Y
E. X2Y3
Jawaban : B
39. Diantara senyawa berikut, senyawa yang mempunyai ikatan rangkap dua adalah...
(nomor atom H = 1 ; C = 6 ; N = 7 ; O = 8 ; Cl = 17 )
A. O2
B. HCl
C. CH4
D. N2
E. NH3
Jawaban : A
40. Diantara senyawa-senyawa berikut yang mempunyai ikatan ion adalah....
A. HBr
B. NaBr
C. Cl2
D. C2H5OH
E. NH3
Jawaban : B
41. Ikatan ion disebabakan oleh adanya....
A. Pemakaian elektron secara sepihak
B. Gaya elektrolisis antara ion positif dan ion negatif
C. Gaya van der waals antara ion-ion
D. Gaya antara proton dan elektron
E. Pemakaian bersama sepasang elektron karena serah terima elektron
Jawaban : E
42. Zat yang bersifat polar adalah....
A. CH4
B. BF3
C. NH3
D. CO2
E. PCl5
Jawaban : C
43. Diantara senyawa di bawah ini yang memiliki ikatan rangkap tiga adalah....
( nomor atom H = 1 ; N = 7; O = 8 ; S = 16 ; Cl = 17)
A. NH3
B. O2
C. H2S
D. N2
E. HCl
Jawaban : D
44. Unsu Ca memiliki nomor atom 20, akan membentuk konfigurasi elektron seperti gas mulia dengan cara....
A. Menerima 1 elektron
B. Menerima 2 elektron
C. Melepas 1 elektron
D. Melepas 2 elektron
E. Melepas 6 elektron
Jawaban : B
45. Deret senyawa berikut ini tergolong senyawa kovalen, kecuali....
A. HF, HCl, HI
B. BH3, BF3, CO2
C. H2O, NH3, CO2
D. Li2O, CaO, MgO
E. IF5, CCl4, ClF3
Jawaban : D
46. Klor dan brom terletak dalam satu golongan karena....
A. Nomor atom sama
B. Jumlah elektron sama
C. Jumlah kulit elektron sama
D. Jumlah elektron valensi sama
E. Jumlah proton sama
Jawaban : D
47. Pasangan unsur dengan nomor atom berikut yang mempunyai sifat sama adalah....
A. 3 dan 13
B. 5 dan 15
C. 11 dan 19
D. 12 dan 18
E. 8 dan 18
Jawaban : C
48. Suatu unsur dengan nomor atom 7 akan mempunyai....
A. 3 kulit elektron dan 3 elektron valensi
B. 3 kulit elektron dan 7 elektron valensi
C. 2 kulit elektron dan 3 elektron valensi
D. 2 kulit elektron dan 5 elektron valensi
E. 2 kulit elektron dan 7 elektron valensi
Jawaban : D
49. Penemu neutron adalah....
A. Chadwick
B. Goldstein
C. Rutherford
D. Thomson
E. Bohr
Jawaban : A
50. Atom yang mempunyai elektron valensi terbanyak adalah unsur yang bernomor atom....
A. 8
B. 10
C. 12
D. 15
E. 16
Jawaban : B
A. XY
B. XY2
C. XY3
D. X2Y
E. X2Y3
Jawaban : B
39. Diantara senyawa berikut, senyawa yang mempunyai ikatan rangkap dua adalah...
(nomor atom H = 1 ; C = 6 ; N = 7 ; O = 8 ; Cl = 17 )
A. O2
B. HCl
C. CH4
D. N2
E. NH3
Jawaban : A
40. Diantara senyawa-senyawa berikut yang mempunyai ikatan ion adalah....
A. HBr
B. NaBr
C. Cl2
D. C2H5OH
E. NH3
Jawaban : B
41. Ikatan ion disebabakan oleh adanya....
A. Pemakaian elektron secara sepihak
B. Gaya elektrolisis antara ion positif dan ion negatif
C. Gaya van der waals antara ion-ion
D. Gaya antara proton dan elektron
E. Pemakaian bersama sepasang elektron karena serah terima elektron
Jawaban : E
42. Zat yang bersifat polar adalah....
A. CH4
B. BF3
C. NH3
D. CO2
E. PCl5
Jawaban : C
43. Diantara senyawa di bawah ini yang memiliki ikatan rangkap tiga adalah....
( nomor atom H = 1 ; N = 7; O = 8 ; S = 16 ; Cl = 17)
A. NH3
B. O2
C. H2S
D. N2
E. HCl
Jawaban : D
44. Unsu Ca memiliki nomor atom 20, akan membentuk konfigurasi elektron seperti gas mulia dengan cara....
A. Menerima 1 elektron
B. Menerima 2 elektron
C. Melepas 1 elektron
D. Melepas 2 elektron
E. Melepas 6 elektron
Jawaban : B
45. Deret senyawa berikut ini tergolong senyawa kovalen, kecuali....
A. HF, HCl, HI
B. BH3, BF3, CO2
C. H2O, NH3, CO2
D. Li2O, CaO, MgO
E. IF5, CCl4, ClF3
Jawaban : D
46. Klor dan brom terletak dalam satu golongan karena....
A. Nomor atom sama
B. Jumlah elektron sama
C. Jumlah kulit elektron sama
D. Jumlah elektron valensi sama
E. Jumlah proton sama
Jawaban : D
47. Pasangan unsur dengan nomor atom berikut yang mempunyai sifat sama adalah....
A. 3 dan 13
B. 5 dan 15
C. 11 dan 19
D. 12 dan 18
E. 8 dan 18
Jawaban : C
48. Suatu unsur dengan nomor atom 7 akan mempunyai....
A. 3 kulit elektron dan 3 elektron valensi
B. 3 kulit elektron dan 7 elektron valensi
C. 2 kulit elektron dan 3 elektron valensi
D. 2 kulit elektron dan 5 elektron valensi
E. 2 kulit elektron dan 7 elektron valensi
Jawaban : D
49. Penemu neutron adalah....
A. Chadwick
B. Goldstein
C. Rutherford
D. Thomson
E. Bohr
Jawaban : A
50. Atom yang mempunyai elektron valensi terbanyak adalah unsur yang bernomor atom....
A. 8
B. 10
C. 12
D. 15
E. 16
Jawaban : B
Soal UAS/PAS Kimia Kelas 11 Semester 1 Kurikulum 2013 Tahun 2019
1. Beberapa sifat reaksi sebagai berikut:
1. ∆H > 0
2. menyebabkan kenaikan suhu lingkungan
3. menyerap kalor
4. hanya dapat berlangsung pada suhu tinggi
5. terjadi aliran kalor dari sistem ke lingkungan
Yang merupakan ciri reaksi endoterm adalah ....
a. 1, 2, dan 4 d. 1, 3, dan 5
b. 1 dan 3 e. 2 dan 4
c. 2, 3, dan 4
Jawaban : B
2. Beberapa sifat reaksi sebagai berikut:
1. ∆H > 0
2. menyebabkan kenaikan suhu lingkungan
3. menyerap kalor
4. terjadi aliran kalor dari sistem ke lingkungan
yang merupakan ciri reaksi eksoterm adalah ....
a. 1, 2, dan 4 d. 1, 3, dan 5
b. 1 dan 3 e. 2 dan 4
c. 2, 3, dan 4
Jawaban : E
3. Diketahui persamaan termokimia:
C(s) + O2(g) ---> CO2(g) ∆H = -400 kJ
Jika entalpi 1 mol C(s) + 1 mol O2(g) = H1 dan entalpi 1 mol CO2(g) = H2, maka . . . .
a. H1 = -400 kJ d. H1 – H2 = -400 kJ
b. H2 = -400 kJ e. H2 – H1 = -400 kJ
c. H1 + H2 = -400 kJ
Jawaban : E
4. Sebuah kristal KNO3 dimasukkan ke dalam tabung reaksi, kemudian ditetesi denga air. Pada dasar tabung reaksi terasa dingin. Reaksi ini dapat digolongkan . . . .
a. eksoterm, energi berpindah dari sistem ke lingkungan d. endoterm, energi berpindah dari lingkungan ke sistem
b. eksoterm, energi berpindah dari lingkungan ke sistem e. endoterm, energi tidak berpindah
c. endoterm, energi berpindah dari sistem ke lingkungan
Jawaban : D
5. Di antara yang berikut ini:
(1) fotosintesis
(2) pembakaran
(3) respirasi
(4) dekomposisi termal
(5) pelelehan
Yang tergolong proses endoterm adalah . . . .
a. (1), (2) dan (3) d. (2), (3) dan (4)
b. (1), (4) dan (5) e. (1), (3), (4) dan (5)
c. (2), (3) dan (5)
Jawaban : E
6. Di antara yang berikut ini:
(1) fotosintesis
(2) pembakaran
(3) respirasi
(4) dekomposisi termal
(5) pelelehan
11. Laju suatu reaksi berubah menjadi dua kali lebih cepat setiap kenaikan suhu 10°C. Jika pada 25°C waktu reaksi adalah 32 detik, maka waktu reaksi pada suhu 45°C dan 65°C berturut-turut adalah . . . .
a. 4 dan 8 detik d. 8 dan 4 detik
b. 8 dan 2 detik e. 6 dan 4 detik
c. 4 dan 16 detik
Jawaban : B
12. Berbagai pernyataan mengenai peran katalis dalam proses reaksi sebagai berikut:
1. mengubah mekanisme dan hasil reaksi
2. tidak ikut bereaksi dalam proses reaksi
3. ikut bereaksi tetapi dapat diperoleh kembali pada akhir reaksi
4. ikut bereaksi dan tidak dapat diperoleh pada akhir reaksi
5. menurunkan energi pengaktifan
Pernyataan yang benar adalah ....
a. 1, 3, dan 5 d. 3 dan 5
b. 1, 4, dan 5 e. 1 dan 5
c. 2 dan 5
Jawaban : D
13. Berbagai pernyataan mengenai peran katalis dalam proses reaksi sebagai berikut:
1. mengubah mekanisme dan hasil reaksi
2. tidak ikut bereaksi dalam proses reaksi
3. ikut bereaksi tetapi dapat diperoleh kembali pada akhir reaksi
4. ikut bereaksi dan tidak dapat diperoleh pada akhir reaksi
5. menurunkan energi pengaktifan
Pernyataan yang tidak benar adalah ....
a. 1, 3, dan 5 d. 3 dan 5
b. 1, 4, dan 5 e. 1 dan 5
c. 1, 2 dan 4
Jawaban : C
14. Reaksi A + B ----> C + D berorde dua terhadap A dan berorde nol terhadap B. Nilai k = 0,02 M-1 det-1. Jika konsentrasi A dan B masing-masing 0,02 M, maka harga laju reaksi adalah ....
a. 2 x 10-4 M det-1 d. 4 x 10-6 M det-1
b. 4 x 10-4 M det-1 e. 8 x 10-6 M det-1
c. 6 x 10-4 M det-1
Jawaban : E
15. Reaksi A + B ----> C + D berorde dua terhadap A dan berorde nol terhadap B. Nilai k = 0,01 M-1 det-1. Jika konsentrasi A dan B masing-masing 0,02 M, maka harga laju reaksi adalah ....
a. 2 x 10-4 M det-1 d. 4 x 10-6 M det-1
b. 4 x 10-4 M det-1 e. 8 x 10-6 M det-1
c. 6 x 10-4 M det-1
Jawaban : D
1. ∆H > 0
2. menyebabkan kenaikan suhu lingkungan
3. menyerap kalor
4. hanya dapat berlangsung pada suhu tinggi
5. terjadi aliran kalor dari sistem ke lingkungan
Yang merupakan ciri reaksi endoterm adalah ....
a. 1, 2, dan 4 d. 1, 3, dan 5
b. 1 dan 3 e. 2 dan 4
c. 2, 3, dan 4
Jawaban : B
2. Beberapa sifat reaksi sebagai berikut:
1. ∆H > 0
2. menyebabkan kenaikan suhu lingkungan
3. menyerap kalor
4. terjadi aliran kalor dari sistem ke lingkungan
yang merupakan ciri reaksi eksoterm adalah ....
a. 1, 2, dan 4 d. 1, 3, dan 5
b. 1 dan 3 e. 2 dan 4
c. 2, 3, dan 4
Jawaban : E
3. Diketahui persamaan termokimia:
C(s) + O2(g) ---> CO2(g) ∆H = -400 kJ
Jika entalpi 1 mol C(s) + 1 mol O2(g) = H1 dan entalpi 1 mol CO2(g) = H2, maka . . . .
a. H1 = -400 kJ d. H1 – H2 = -400 kJ
b. H2 = -400 kJ e. H2 – H1 = -400 kJ
c. H1 + H2 = -400 kJ
Jawaban : E
4. Sebuah kristal KNO3 dimasukkan ke dalam tabung reaksi, kemudian ditetesi denga air. Pada dasar tabung reaksi terasa dingin. Reaksi ini dapat digolongkan . . . .
a. eksoterm, energi berpindah dari sistem ke lingkungan d. endoterm, energi berpindah dari lingkungan ke sistem
b. eksoterm, energi berpindah dari lingkungan ke sistem e. endoterm, energi tidak berpindah
c. endoterm, energi berpindah dari sistem ke lingkungan
Jawaban : D
5. Di antara yang berikut ini:
(1) fotosintesis
(2) pembakaran
(3) respirasi
(4) dekomposisi termal
(5) pelelehan
Yang tergolong proses endoterm adalah . . . .
a. (1), (2) dan (3) d. (2), (3) dan (4)
b. (1), (4) dan (5) e. (1), (3), (4) dan (5)
c. (2), (3) dan (5)
Jawaban : E
6. Di antara yang berikut ini:
(1) fotosintesis
(2) pembakaran
(3) respirasi
(4) dekomposisi termal
(5) pelelehan
Yang tergolong proses eksoterm adalah . . . .
a. (2) dan (3) d. (2), (3) dan (4)
b. (1), (4) dan (5) e. (1), (3), (4) dan (5)
c. (2), (3) dan (5)
Jawaban : A
7. Persamaan reaksi yang perubahan entalpinya dapat disebut sebagai entalpi pembentukan ialah .....
a. N2(g) + 3H2(g) ----> 2NH3(g) ∆H = -92,2 kJ d. SO3(g) + H2O(l) ----> H2SO4(l) ∆H = -300 kJ
b. CH4(g) + 2O2(g) ----> CO2(g) + 2H2O(g) ∆H = -890 kJ e. Ca(s) + 2Cl(g) ----> CaCl2(s) ∆H = -1000 kJ
c. 2C(s) + 2H(g) + O2(g) ----> C2H4O2(l) ∆H = -487 kJ
Jawaban : A
8. Persamaan reaksi yang perubahan entalpinya dapat disebut sebagai entalpi pembakaran metana ialah .....
a. N2(g) + 3H2(g) ----> 2NH3(g) ∆H = -92,2 kJ d. SO3(g) + H2O(l) ----> H2SO4(l) ∆H = -300 kJ
b. CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ∆H = -890 kJ e. Ca(s) + 2Cl(g) ----> CaCl2(s) ∆H = -1000 kJ
c. 2C(s) + 2H(g) + O2(g) ----> C2H4O2(l) ∆H = -487 kJ
Jawaban : B
9. Pada pembentukan 1 gram gas metana (CH4) dibebaskan 55,6 kJ. Dapat dikatakan entalpi pembentukan metana adalah . . . . (H = 1; C = 12)
a. -55,6 kJ mol-1 d. -889,6 kJ mol-1
b. +55,6 kJ mol-1 e. +889,6 kJ mol-1
c. -667,2 kJ1
Jawaban : D
10. Pada pembentukan 16 gram gas metana (CH4) dibebaskan 55,6 kJ. Dapat dikatakan entalpi pembentukan metana adalah . . . . (H = 1; C = 12)
a. -55,6 kJ mol-1 d. -889,6 kJ mol-1
b. +55,6 kJ mol-1 e. +889,6 kJ mol-1
c. -667,2 kJ1
Jawaban : A
a. (2) dan (3) d. (2), (3) dan (4)
b. (1), (4) dan (5) e. (1), (3), (4) dan (5)
c. (2), (3) dan (5)
Jawaban : A
7. Persamaan reaksi yang perubahan entalpinya dapat disebut sebagai entalpi pembentukan ialah .....
a. N2(g) + 3H2(g) ----> 2NH3(g) ∆H = -92,2 kJ d. SO3(g) + H2O(l) ----> H2SO4(l) ∆H = -300 kJ
b. CH4(g) + 2O2(g) ----> CO2(g) + 2H2O(g) ∆H = -890 kJ e. Ca(s) + 2Cl(g) ----> CaCl2(s) ∆H = -1000 kJ
c. 2C(s) + 2H(g) + O2(g) ----> C2H4O2(l) ∆H = -487 kJ
Jawaban : A
8. Persamaan reaksi yang perubahan entalpinya dapat disebut sebagai entalpi pembakaran metana ialah .....
a. N2(g) + 3H2(g) ----> 2NH3(g) ∆H = -92,2 kJ d. SO3(g) + H2O(l) ----> H2SO4(l) ∆H = -300 kJ
b. CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ∆H = -890 kJ e. Ca(s) + 2Cl(g) ----> CaCl2(s) ∆H = -1000 kJ
c. 2C(s) + 2H(g) + O2(g) ----> C2H4O2(l) ∆H = -487 kJ
Jawaban : B
9. Pada pembentukan 1 gram gas metana (CH4) dibebaskan 55,6 kJ. Dapat dikatakan entalpi pembentukan metana adalah . . . . (H = 1; C = 12)
a. -55,6 kJ mol-1 d. -889,6 kJ mol-1
b. +55,6 kJ mol-1 e. +889,6 kJ mol-1
c. -667,2 kJ1
Jawaban : D
10. Pada pembentukan 16 gram gas metana (CH4) dibebaskan 55,6 kJ. Dapat dikatakan entalpi pembentukan metana adalah . . . . (H = 1; C = 12)
a. -55,6 kJ mol-1 d. -889,6 kJ mol-1
b. +55,6 kJ mol-1 e. +889,6 kJ mol-1
c. -667,2 kJ1
Jawaban : A
11. Laju suatu reaksi berubah menjadi dua kali lebih cepat setiap kenaikan suhu 10°C. Jika pada 25°C waktu reaksi adalah 32 detik, maka waktu reaksi pada suhu 45°C dan 65°C berturut-turut adalah . . . .
a. 4 dan 8 detik d. 8 dan 4 detik
b. 8 dan 2 detik e. 6 dan 4 detik
c. 4 dan 16 detik
Jawaban : B
12. Berbagai pernyataan mengenai peran katalis dalam proses reaksi sebagai berikut:
1. mengubah mekanisme dan hasil reaksi
2. tidak ikut bereaksi dalam proses reaksi
3. ikut bereaksi tetapi dapat diperoleh kembali pada akhir reaksi
4. ikut bereaksi dan tidak dapat diperoleh pada akhir reaksi
5. menurunkan energi pengaktifan
Pernyataan yang benar adalah ....
a. 1, 3, dan 5 d. 3 dan 5
b. 1, 4, dan 5 e. 1 dan 5
c. 2 dan 5
Jawaban : D
13. Berbagai pernyataan mengenai peran katalis dalam proses reaksi sebagai berikut:
1. mengubah mekanisme dan hasil reaksi
2. tidak ikut bereaksi dalam proses reaksi
3. ikut bereaksi tetapi dapat diperoleh kembali pada akhir reaksi
4. ikut bereaksi dan tidak dapat diperoleh pada akhir reaksi
5. menurunkan energi pengaktifan
Pernyataan yang tidak benar adalah ....
a. 1, 3, dan 5 d. 3 dan 5
b. 1, 4, dan 5 e. 1 dan 5
c. 1, 2 dan 4
Jawaban : C
14. Reaksi A + B ----> C + D berorde dua terhadap A dan berorde nol terhadap B. Nilai k = 0,02 M-1 det-1. Jika konsentrasi A dan B masing-masing 0,02 M, maka harga laju reaksi adalah ....
a. 2 x 10-4 M det-1 d. 4 x 10-6 M det-1
b. 4 x 10-4 M det-1 e. 8 x 10-6 M det-1
c. 6 x 10-4 M det-1
Jawaban : E
15. Reaksi A + B ----> C + D berorde dua terhadap A dan berorde nol terhadap B. Nilai k = 0,01 M-1 det-1. Jika konsentrasi A dan B masing-masing 0,02 M, maka harga laju reaksi adalah ....
a. 2 x 10-4 M det-1 d. 4 x 10-6 M det-1
b. 4 x 10-4 M det-1 e. 8 x 10-6 M det-1
c. 6 x 10-4 M det-1
Jawaban : D
1. larutan NaOH 30 % massa memiliki massa jenis 1,33 g / ml . Molaritas larutan ini adalah ....
A 8,25
B 9,98
C 16,0
D 33,2
E 64,00
A 8,25
B 9,98
C 16,0
D 33,2
E 64,00
Jawaban : B
2. Kemolalan larutan C2H5OH 20% massa ( Mr = 46 ) adalah ....
A 6,4
B 5,4
C 4,4
D 3,4
E 0,4
2. Kemolalan larutan C2H5OH 20% massa ( Mr = 46 ) adalah ....
A 6,4
B 5,4
C 4,4
D 3,4
E 0,4
Jawaban : B
3. Untuk membuat larutan NaOH 2 molal , diperlukan ..... ( Ar Na = 23 )
A 8 gram NaOH dan 92 gram H2O
B 8 gram NaOH dan 100 gram H2O
C 10 gram NaOH dan 90 gram H2O
D 4 gram NaOH dan 100 gram H2O
E 80 gram NaOH dan 2 liter H2O
3. Untuk membuat larutan NaOH 2 molal , diperlukan ..... ( Ar Na = 23 )
A 8 gram NaOH dan 92 gram H2O
B 8 gram NaOH dan 100 gram H2O
C 10 gram NaOH dan 90 gram H2O
D 4 gram NaOH dan 100 gram H2O
E 80 gram NaOH dan 2 liter H2O
Jawaban : B
4. Suatu senyawa karbon tersusun dari 40 % C , 6,6 % H dan sisanya O . Jika 9 gram senyawa ini dilarutkan dalam 25 gram air ( Kf = 1,86 oC /molal ) dam membeku pada suhu - 3,72 oC maka rumus molekulnya adalah ....
A C3H6O2
B C3H6O3
C C4H10O2
D C5H10O5
E C6H12O6
4. Suatu senyawa karbon tersusun dari 40 % C , 6,6 % H dan sisanya O . Jika 9 gram senyawa ini dilarutkan dalam 25 gram air ( Kf = 1,86 oC /molal ) dam membeku pada suhu - 3,72 oC maka rumus molekulnya adalah ....
A C3H6O2
B C3H6O3
C C4H10O2
D C5H10O5
E C6H12O6
Jawaban : E
5. Suatu senyawa X ( Mr = 100 ) yang tidak dapat menghantarkan arus listrik dilarutkan dalam 250 gram benzena ternyata memberikan penurunan titik beku ( Tb. ) sebesar 1,024 0 C. Jika diketahui harga Kf benzena = 5,12 0C /m maka massa senyawa yang dilarutkan .....
A 0,5 gram
B 2,5 gram
C 5,0 gram
D 7,5 gram
E 10 gram
5. Suatu senyawa X ( Mr = 100 ) yang tidak dapat menghantarkan arus listrik dilarutkan dalam 250 gram benzena ternyata memberikan penurunan titik beku ( Tb. ) sebesar 1,024 0 C. Jika diketahui harga Kf benzena = 5,12 0C /m maka massa senyawa yang dilarutkan .....
A 0,5 gram
B 2,5 gram
C 5,0 gram
D 7,5 gram
E 10 gram
Jawaban : C
6. Jika 87,75 gram NaCl dilarutkan dalam 7,5 kg air murni , maka larutan dalam keadaan normal ( P = 1 atm ) yang terjadi akan memiliki titik beku dan titik didih sebesar .....( Ar Na= 23 ; Cl = 35,5 Kf air = 1,86 0C /molal ; Kb air = 0,52 0C / molal )
A - 0,774 °C dan 103,72 0C
6. Jika 87,75 gram NaCl dilarutkan dalam 7,5 kg air murni , maka larutan dalam keadaan normal ( P = 1 atm ) yang terjadi akan memiliki titik beku dan titik didih sebesar .....( Ar Na= 23 ; Cl = 35,5 Kf air = 1,86 0C /molal ; Kb air = 0,52 0C / molal )
A - 0,774 °C dan 103,72 0C
B - 0,774 °C dan 100,2 0C
C - 0,372 °C dan 100,2 0C
D - 0,2 °C dan 100,372 0C
E - 0,2 °C dan 100,744 0C
Jawaban : E
7. Sebanyak 45 gram senyawa dengan rumus molekul ( H2CO )x dilarutkan dalam 500 gram air ( Kf air = 1,86 0C/ molal ) Jika titik beku senyawa ini 0,93 0C dan ar C = 12 H =1 dan O = 16 maka harga X adalah .....
A 12
B 10
C 8
D 6
E 4
7. Sebanyak 45 gram senyawa dengan rumus molekul ( H2CO )x dilarutkan dalam 500 gram air ( Kf air = 1,86 0C/ molal ) Jika titik beku senyawa ini 0,93 0C dan ar C = 12 H =1 dan O = 16 maka harga X adalah .....
A 12
B 10
C 8
D 6
E 4
Jawaban : D
8. Larutan gula (C12H22O11) 0,2 molal mendidih pada suhu 100,1 ºC, maka titik didih larutan CaCl2 0,1 molal adalah .....
A 100.025 °C
8. Larutan gula (C12H22O11) 0,2 molal mendidih pada suhu 100,1 ºC, maka titik didih larutan CaCl2 0,1 molal adalah .....
A 100.025 °C
B 100.045 °C
C 100.075 °C
D 100.100°C
E 100.150 °C
Jawaban : E
9. Titik beku dari larutan NaCl 0,1 m Jika Kf air = 1,86 adalah ....
A - 0, 186 0C
B - 0, 272 0C
C - 0, 372 0C
D - 0, 486 0C
E - 0, 586 0C
9. Titik beku dari larutan NaCl 0,1 m Jika Kf air = 1,86 adalah ....
A - 0, 186 0C
B - 0, 272 0C
C - 0, 372 0C
D - 0, 486 0C
E - 0, 586 0C
Jawaban : C
10. Senyawa garam BaCl2 ( Mr = 208 ) sebanyak 41,6 gram dilarutkan dalam air hingga volumenya 5 liter . Tekanan osmotik larutan tersebut pada suhu 27°C adalah ...
10. Senyawa garam BaCl2 ( Mr = 208 ) sebanyak 41,6 gram dilarutkan dalam air hingga volumenya 5 liter . Tekanan osmotik larutan tersebut pada suhu 27°C adalah ...
A 2,952 atm
B 3,054 atm
C 4, 555 atm
D 5,066 atm
E 5,555 atm
B 3,054 atm
C 4, 555 atm
D 5,066 atm
E 5,555 atm
Jawaban : A
11. Tekanan uap pelarut air pada suhu 26°C sebesar 25 mm Hg . Jika tekanan uap larutan sebesar 20 mm Hg pada suhu tersebut , maka fraksi mol zat terlarut dalam larutan tersebut adalah ....
11. Tekanan uap pelarut air pada suhu 26°C sebesar 25 mm Hg . Jika tekanan uap larutan sebesar 20 mm Hg pada suhu tersebut , maka fraksi mol zat terlarut dalam larutan tersebut adalah ....
A 0,2
B 0,8
C 0,5
D 0,4
E 0,6
B 0,8
C 0,5
D 0,4
E 0,6
Jawaban : A
12. Larutan urea dalam air mendidik pada suhu 105,2 °C dan tekanan 1 atmosfer . Jika Mr urea = 60 dam Kb air = 0,52 , maka kadar larutan urea sebesar ....
12. Larutan urea dalam air mendidik pada suhu 105,2 °C dan tekanan 1 atmosfer . Jika Mr urea = 60 dam Kb air = 0,52 , maka kadar larutan urea sebesar ....
A 37,5 %
B 60 %
C 75 %
D 90 %
E 97 %
B 60 %
C 75 %
D 90 %
E 97 %
Jawaban : A
13. Tekanan osmotik suatu larutan non elektrolit pada suhu 27°C sebesar 2,46 atm Jika R = 0,082 L atm/mol K , maka banyakya zat terlarut per liter larutan sebesar ....
13. Tekanan osmotik suatu larutan non elektrolit pada suhu 27°C sebesar 2,46 atm Jika R = 0,082 L atm/mol K , maka banyakya zat terlarut per liter larutan sebesar ....
A 0,1 mol
B 0,01 mol
C 0,2 mol
D 0,02 mol
E 0,5 mol
B 0,01 mol
C 0,2 mol
D 0,02 mol
E 0,5 mol
Jawaban : A
14. Pada 27°C tekanan osmosis darah 4,92 atm . Glukosa yang harus digunakan untuk injeksi ke pembuluh darah agar larutan tersebut sama tekanan osmosisnya dengan darah adalah .... ( Mr glukosa = 180 dan R = 0,082 )
14. Pada 27°C tekanan osmosis darah 4,92 atm . Glukosa yang harus digunakan untuk injeksi ke pembuluh darah agar larutan tersebut sama tekanan osmosisnya dengan darah adalah .... ( Mr glukosa = 180 dan R = 0,082 )
A 18 gram /L
B 36 gram /L
C 45 gram /L
D 54 gram /L
B 36 gram /L
C 45 gram /L
D 54 gram /L
E 90 gram /L
Jawaban : B
15. Larutan yang mengandung 5,25 gram asam hipoklorit ( HCLO ) dalam 100 gram air membeku pada temperatur 271,074 K. Jika Kf = 1,86 0 C/m maka % HCLO yang terionnisasi dalam ar adalah .....
A 1 %
B 2%
C 3%
D 4%
E 5%
15. Larutan yang mengandung 5,25 gram asam hipoklorit ( HCLO ) dalam 100 gram air membeku pada temperatur 271,074 K. Jika Kf = 1,86 0 C/m maka % HCLO yang terionnisasi dalam ar adalah .....
A 1 %
B 2%
C 3%
D 4%
E 5%
Jawaban : E
16. Logam berikut yang dapat mencegah korosi pipa besi yang di tanam di dalam tanah adalah . . ..
A Cu
B Zn
C Ni
D Pb
E Mg
16. Logam berikut yang dapat mencegah korosi pipa besi yang di tanam di dalam tanah adalah . . ..
A Cu
B Zn
C Ni
D Pb
E Mg
Jawaban : E
17. Warna nyala senyawa natrium, barium dan stronsium adalah . . . .
Natrium Barium Stronsium
A kuning - hijau - merah
B merah - ungu - hijau
C jingga- kuning - merah
D. kuning - biru - merah
E ungu - jingga-biru
17. Warna nyala senyawa natrium, barium dan stronsium adalah . . . .
Natrium Barium Stronsium
A kuning - hijau - merah
B merah - ungu - hijau
C jingga- kuning - merah
D. kuning - biru - merah
E ungu - jingga-biru
Jawaban : A
18. Peleburan aluminium dilakukan dengan elekrolisis, yaitu elektrolisis larutan Al2O3 dalam kriolit cair. Fungsi utama dari kriolit adalah . . . .
A menurunkan titik leleh campuran
B menambah jumlah aluminium
C memperbaiki dayahantar campuran
D mencegah oksidasi kembali aluminium
E mencegah oksidasi anode grafit
18. Peleburan aluminium dilakukan dengan elekrolisis, yaitu elektrolisis larutan Al2O3 dalam kriolit cair. Fungsi utama dari kriolit adalah . . . .
A menurunkan titik leleh campuran
B menambah jumlah aluminium
C memperbaiki dayahantar campuran
D mencegah oksidasi kembali aluminium
E mencegah oksidasi anode grafit
Jawaban : A
19. Unsur di bawah ini yang paling kecil kemungkinannya bereaksi dengan florin adalah . . .
A Helium
B Argon
C Radon
D Neon
E Xenon
19. Unsur di bawah ini yang paling kecil kemungkinannya bereaksi dengan florin adalah . . .
A Helium
B Argon
C Radon
D Neon
E Xenon
Jawaban : E
20. Senyawa nitrogen yang banyak digunakan sebagai pupuk . . .
A CO(NH2)2
B NaNO3
C Na2SO4
D NH3
E NaNO2
20. Senyawa nitrogen yang banyak digunakan sebagai pupuk . . .
A CO(NH2)2
B NaNO3
C Na2SO4
D NH3
E NaNO2
Jawaban : A
21. Berikut senyawa yang mengandung unsur golongan IA dan II A
1. KNO3 4. SrSO4
2.NaIO3 5. Na2SO4
3.CaC2 6. K2SO4
Senyawa yang digunakan untuk membuat campuran garam dapur dan mematangkan buah adalah ....
A 1 dan 2
B 2 dan 3
C 3 dan 4
D 4 dan 5
E 5 dan 6
21. Berikut senyawa yang mengandung unsur golongan IA dan II A
1. KNO3 4. SrSO4
2.NaIO3 5. Na2SO4
3.CaC2 6. K2SO4
Senyawa yang digunakan untuk membuat campuran garam dapur dan mematangkan buah adalah ....
A 1 dan 2
B 2 dan 3
C 3 dan 4
D 4 dan 5
E 5 dan 6
Jawaban : B
22. Perhatikan sifat unsur berikut :
1. dapat menghitamkan plat foto
2. memancarkan cahaya tampak
3. memancarkan sinar ultra ungu
4. memancarkan radiasi dengan daya tembus kuat
A 1 dan 2
B 1 dan 3
C 1 dan 4
D 2 dan 4
E 3 dan 4
22. Perhatikan sifat unsur berikut :
1. dapat menghitamkan plat foto
2. memancarkan cahaya tampak
3. memancarkan sinar ultra ungu
4. memancarkan radiasi dengan daya tembus kuat
A 1 dan 2
B 1 dan 3
C 1 dan 4
D 2 dan 4
E 3 dan 4
Jawaban : C
23. Kedalam larutan NISO4 dialirkan arus listrik sebesar 0,2 faraday. Tentukan volume gas oksigen yang dihasilkan di anoda jika diukur pada keadaan standart .
A 1,15 liter
B 1,12 liter
C 2 liter
D 2,5 liter
E 3 liter
23. Kedalam larutan NISO4 dialirkan arus listrik sebesar 0,2 faraday. Tentukan volume gas oksigen yang dihasilkan di anoda jika diukur pada keadaan standart .
A 1,15 liter
B 1,12 liter
C 2 liter
D 2,5 liter
E 3 liter
Jawaban : B
24. Berikut ini adalah beberapa sifat unsur :
1. Berwujud padat
2. Mudah membentuk ion bermuatan -2
3. Memiliki beberapa bilangan oksidasi .
4. Membentuk unsur diatomik.
Sifat yang dimiliki oleh unsur alkali tanah adalah nomer :....
A 1 dan 2
B 1 dan 3
C 2 dan 3
D 2 dan 4
E 3 dan 4
24. Berikut ini adalah beberapa sifat unsur :
1. Berwujud padat
2. Mudah membentuk ion bermuatan -2
3. Memiliki beberapa bilangan oksidasi .
4. Membentuk unsur diatomik.
Sifat yang dimiliki oleh unsur alkali tanah adalah nomer :....
A 1 dan 2
B 1 dan 3
C 2 dan 3
D 2 dan 4
E 3 dan 4
Jawaban : D
25. Beberapa metode pencegahan korosi besi :
1. mengecet
2. melumori oli
3. dibalut dengan plastik
4. perlindungan katodik
5. galvanisasi
Metode yang paling tepat digunakan untuk melindungi pipa besiyang ada di dalam tanah adalah .....
A 1
B 2
C 3
D 4
E 5
25. Beberapa metode pencegahan korosi besi :
1. mengecet
2. melumori oli
3. dibalut dengan plastik
4. perlindungan katodik
5. galvanisasi
Metode yang paling tepat digunakan untuk melindungi pipa besiyang ada di dalam tanah adalah .....
A 1
B 2
C 3
D 4
E 5
Jawaban : D
Download Soal Lainnya !!!
Diharapkan dengan Soal UAS/PAS Kimia Kelas 10 11 12 Semester 1 Kurikulum 2013 Tahun 2019 ini dapat membantu guru dan siswa dalam membuat persiapan sebelum pelaksanaan ujian. Kritik dan Saran sangat saya harapkan demi kemajuan blog ini dimasa yang akan datang. Blog ini menyediakan berbagai Soal Latihan Ujian jenjang SMA/MA/SMK secara lengkap seperti UN, USBN, UTS, UAS, dan UKK yang bisa anda download secara gratis.



Posting Komentar